EBioquímica evolutiva de las Serpinas transportadoras de biliverdina (BBS, del inglés Biliverdin Binding Sepins): noveades bioquímicas que causan el color verde de las ranas
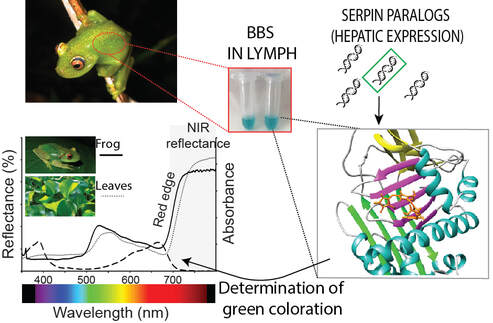
Muchas especies de ranas arborícolas alrededor de mundo, tienen ópticas que las vuelven indistinguibles de foliaje donde habitan. Esta similitud va más alla de su color verde: muchas de estas ranas tienen matices, saturaciones y brillos idénticos a los de as hojas, tanto en la región visible del espectro electromagnético como en el infrarrojo cercano (NIR, del inglés Near-Infrared).
Nuestro trabajo demostró que la coloración verde en las ranas arborícolas surgió muchas veces en la historia evolutiva de los anfibios. Sin embargo, a pesar de estos múltiples orígenes, encotramos que en la la mayoría de los casos la coloración verde depende del mismo truco bioquímico: la expresión de un grupo de proteínas coloreadas de la superfamilia de las serpinas.
Nuestro trabajo demostró que la coloración verde en las ranas arborícolas surgió muchas veces en la historia evolutiva de los anfibios. Sin embargo, a pesar de estos múltiples orígenes, encotramos que en la la mayoría de los casos la coloración verde depende del mismo truco bioquímico: la expresión de un grupo de proteínas coloreadas de la superfamilia de las serpinas.
Los inhibidores de serin proteasas (Serpinas) pertenecen a la superfamilia más grande de inhibidores de proteasa y son conocidas por su capacidad de cambiar dramáticamente su conformación durante el proceso de inhibición de sus prorteasas blanco. En vertebrados, las serpinas son componentes fundamentales en las cascadas de regulación de la coagulación sanguínea y de los procesos inflamatorios. Recientemente descubrimos que, durante la historia evolutiva de las ranas, diversos clados han co-optado al menos una proteína del grupo de las serpinas que sufrió un conjunto de sustituciones aminoacídicas que les otorgaron una alta afinidad por la biliverdina (De ahí el nombre BBS, del inglés Biliverdin Binding Serpin). Cuando se foma el complejo serpina-biliverdina, el color normal de la biliverdina libre en solución cambia, tornándose más parecido al de los pigmentos vegetales como la clorofila y los fitocromos. Nuestros resultados mostaron que, con más de 40 orígenes independientes, el uso de BBS en la creación del color verde en ranas e s uno de los ejemplos más llamativos de convergencia en la naturaleza.
En el laboratorio, utilizamos métodos bioquímicos para purificar, secuenciar y caracterizar las propiedades biofísicas de las BBSs de múltiples especies con orígenes evolutivos independientes. Estamos fundamentalmente interesados en estudiar cómo la evolución de sus secuencias dió lugar a diversos mecanismos de unión a la biliverdina, y cómo los cambios locales en los sitios de unión permitieron ajustar con precisión las propiedades ópticas de las BBSs de manera de crear diferentes saturaciones, matices y brillos en las ranas arborícolas. Actualmente contamos con numerosas BBSs de múltiples orígenes independientes, incluiyendo especies de Hylidos, Centrolenidos, Hyperolidos y Mantelidos. Dada la complejidad del espacio de secuencias (diferentes BBS tienen una identidad de ~50 %) en nuestra investigación utilizamos un marco de bioquímica evolutiva para reconstruir las proteínas ancestrales, expresar experimentalmente esos ancestros y dilucidar la secuencias de cambios que llevaron a las propiedades biofísicas de cada BBS.
.
.
En nuestra investigación utilizamos métodos bioquímicos, biofísicos y de biología evolutiva, incluyendo la expresión de proteínas recombinantes, purificación de variantes o isoformas naturales, espectroscopía de fluorescencia, espectrometría de masa, calorimetría de titulación isotérmica, dicroísmo circular, imágenes en NIR, transcriptómica y varios métodos para medir y simular la propagación de la luz y la creación de colores.
|
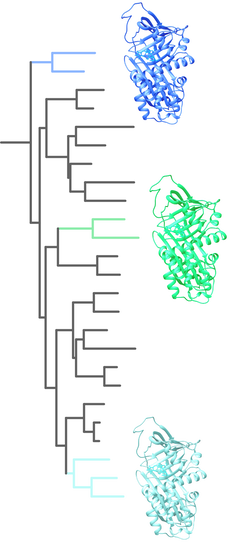
BBSs arose multiple times along the evolutionary history of frogs.
All of them create the leaf-like coloration of treefrogs but rely on different biophysical properties of BBSs that were tuned by aminoacid substitutions tuned over millions of years. BBSs from different species have only 40-75% identity, which for a protein of 400 amino acids means that roughly ~200 amino acids in the BBSs structure are conserved between them. An evolutionary biochemistry approach allows us to investigate the changes in the sequence space that allowed the biochemical changes to bind biliverdin and ultimately produce colors. |